
Personnel d'un organisme de recherche
Rupamanjari MAJUMDER
Coordonnées
Thèmes de recherche
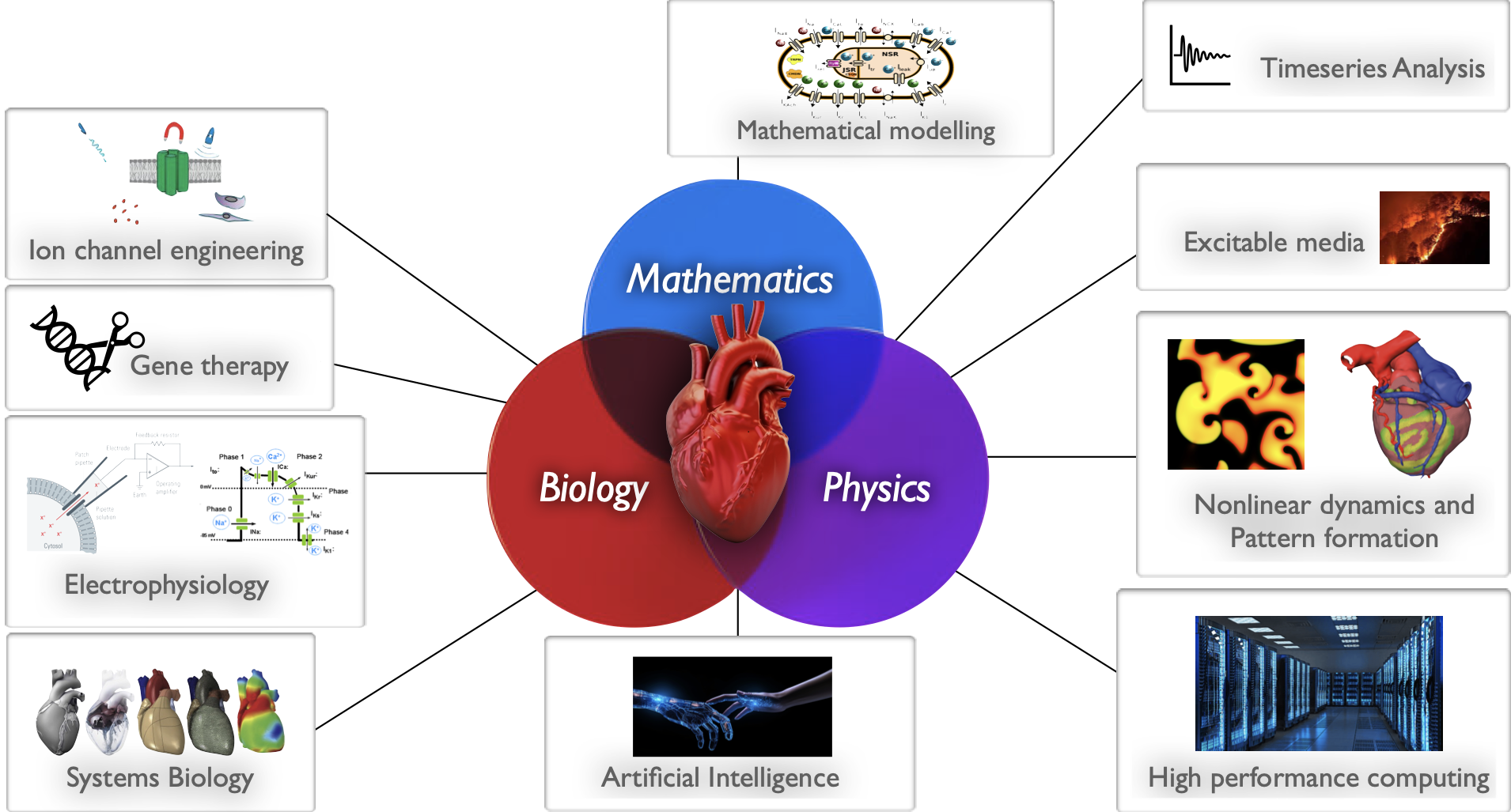
Mon travail adopte une approche ascendante de la recherche sur l'arythmie cardiaque. Au niveau subcellulaire, je développe des empreintes digitales pour des canaux ioniques personnalisés. Ensemble, ces canaux ioniques forment le modèle cellulaire que je conçois sur la base des données électrophysiologiques obtenues expérimentalement.
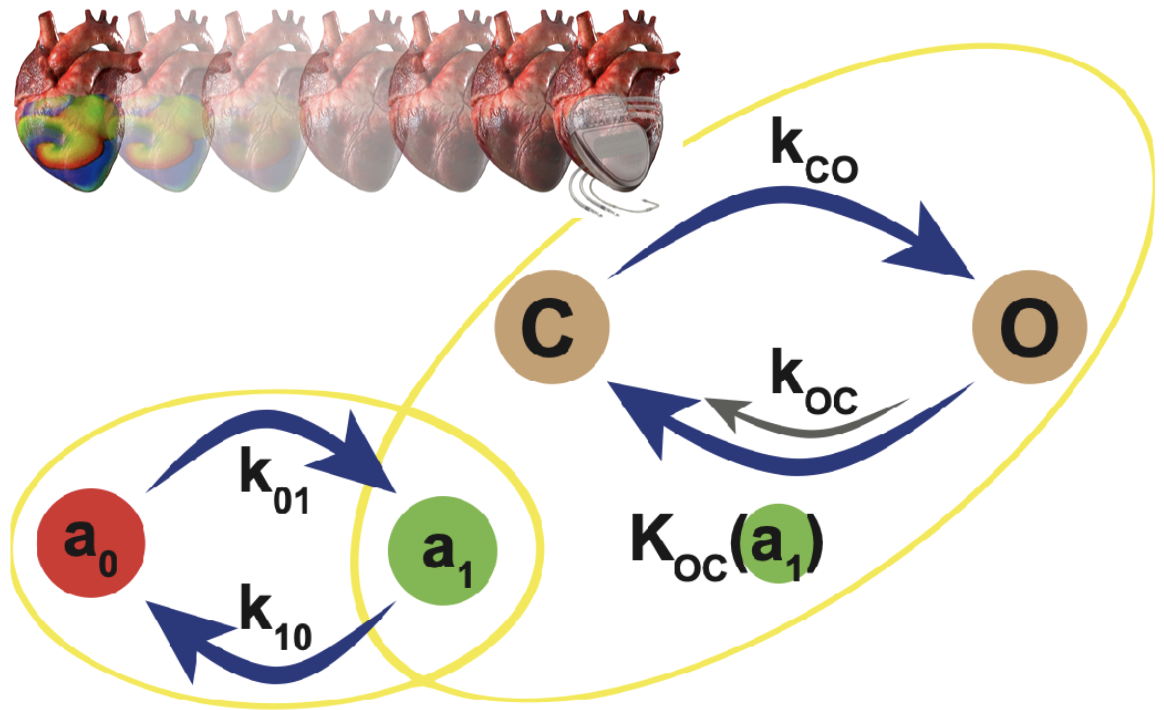
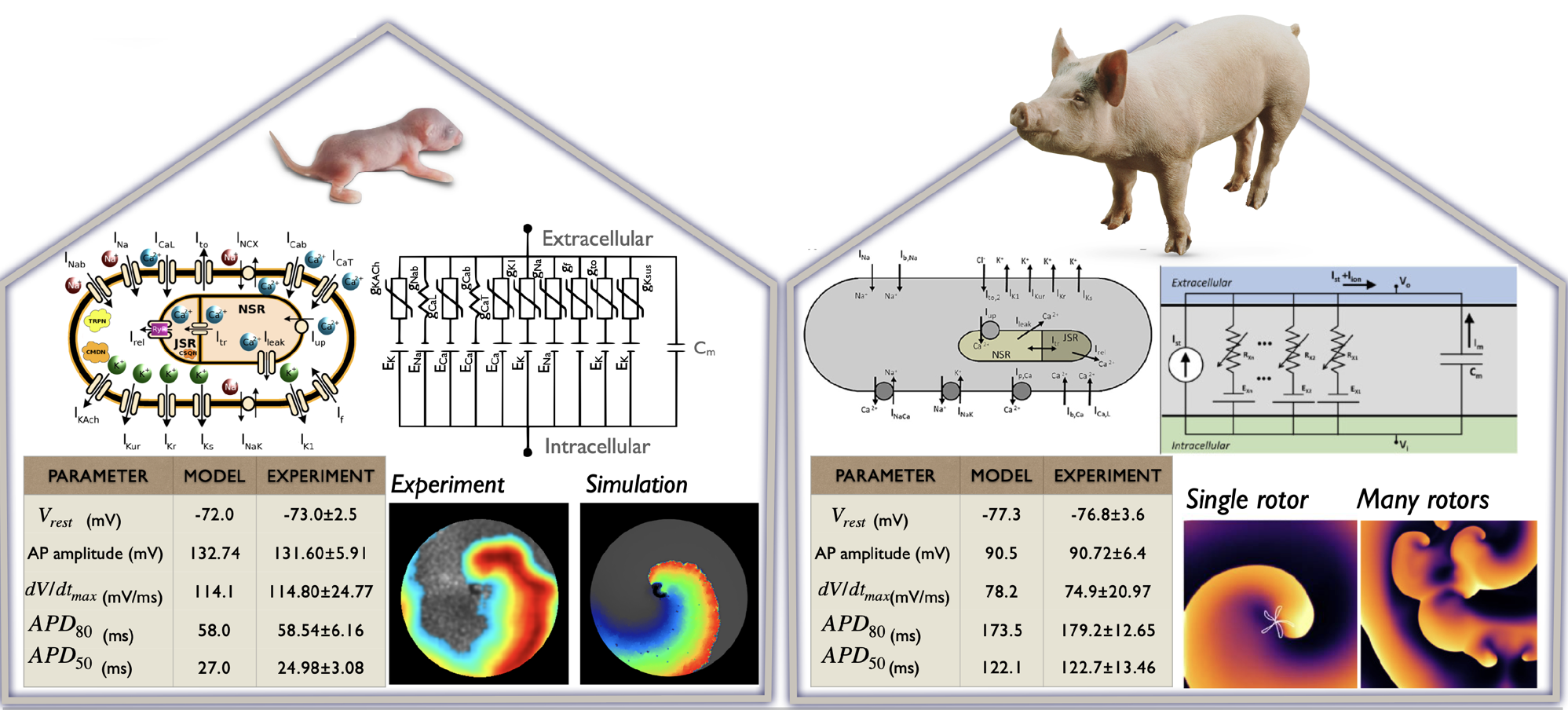
(Gauche) Conception de canaux ioniques (l'exemple illustré est le BioICD : Majumder et al. eLife 2020). (À droite) Modèles mathématiques de cardiomyocytes auriculaires de rat néonatal (Majumder et al. PLoS Comp Biol, 2016) et de porc adulte (Peris et al. Front Physiol, 2022).
Une fois le modèle cellulaire développé, je l'étend à des dimensions supérieures pour simuler la dynamique spatio-temporelle des ondes électriques dans le tissu cardiaque. Mes travaux portent en particulier sur (i) l'émergence d'ondes en spirale (apparition d'arythmies), (ii) leur interaction avec des inhomogénéités (arythmies en présence de tissu cicatriciel), (iii) les transitions entre différents états d'ondes en spirale (arythmies changeant de morphologie), (iv) l'apparition de turbulences électriques (apparition de fibrillation) et (v) les méthodes à faible énergie pour contrôler ces ondes dans différents substrats de la maladie (défibrillation cardiaque). Pour comprendre les mécanismes sous-jacents aux arythmies cardiaques mortelles en monocouche, j'utilise l'optogénétique cardiaque, une technique de pointe qui dote les cellules cardiaques ordinaires, photoinsensibles, d'une photosensibilité à la lumière de longueurs d'onde spécifiques. J'utilise cette technique pour comprendre, manipuler et contrôler la dynamique complexe des ondes en spirale (arythmies).
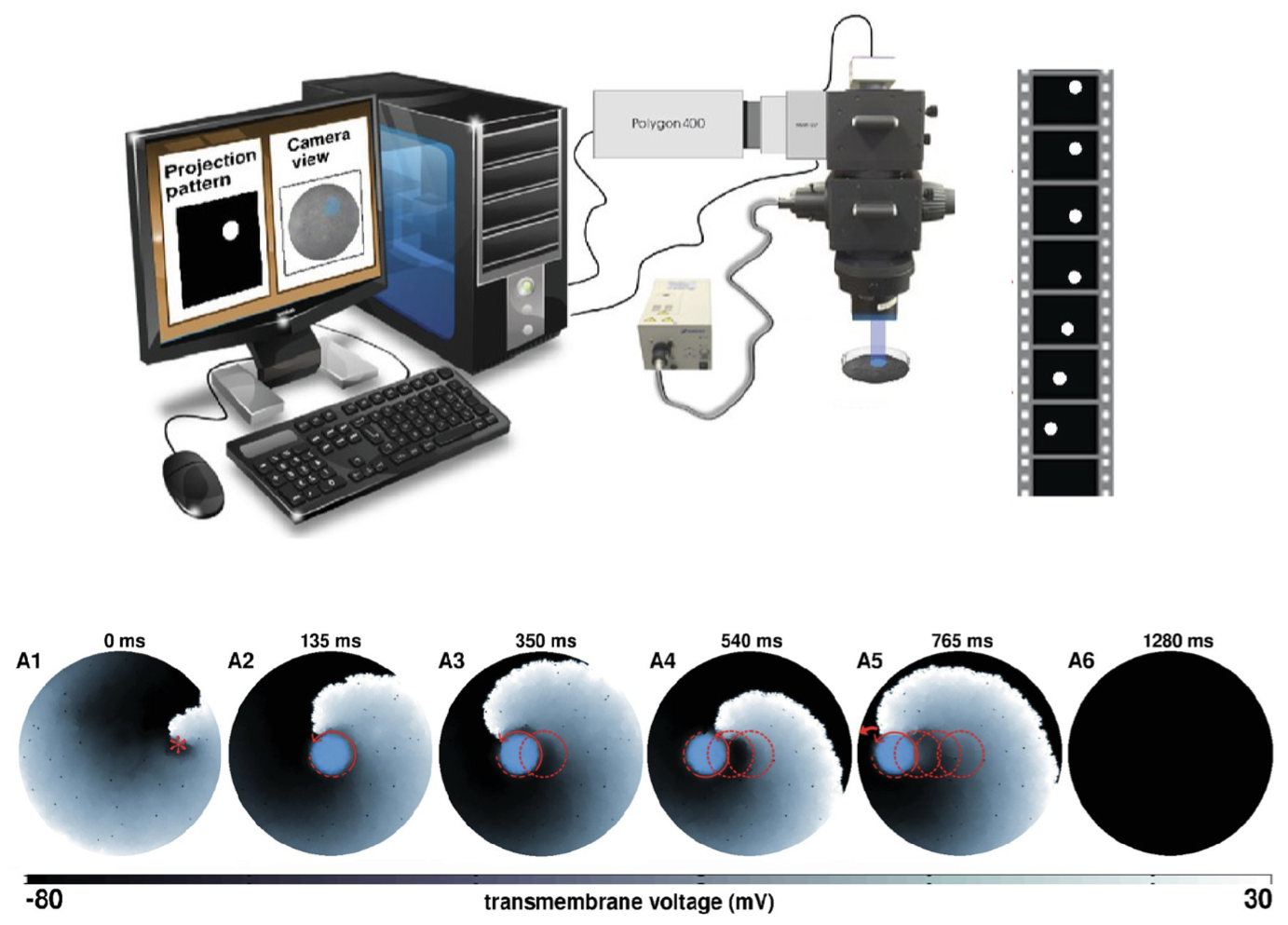
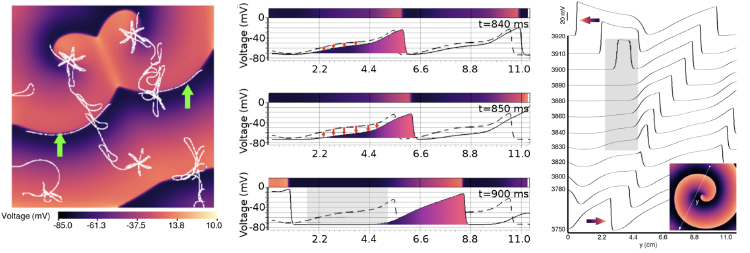
(Gauche) Manipulation des ondes spirales dans une culture cellulaire cardiaque in silico à l'aide de l'optogénétique (Majumder et al. eLife, 2018) (Droite) Démêler les mécanismes d'initiation de la rupture d'onde (initiation d'arythmies complexes) dans un modèle in silico de tissu auriculaire humain (Majumder et al. PLoS Comp Biol, 2021).
Enfin, j'étudie la manifestation d'un état pathologique au niveau de l'organe. Je travaille actuellement au développement d'une plateforme numérique intégrée à plusieurs échelles - le Heart-by-Numbers - pour le cœur humain, qui peut être utilisée par les cliniciens pour prédire la trajectoire d'une arythmie, de son apparition à sa progression, sur la base d'enregistrements ECG. La plateforme est également destinée à tester de nouvelles approches thérapeutiques, telles que la photopharmacologie.
Activités / CV
Expérience de la recherche:
- Jan 2024 - present: Chair of Junior Professor (INSERM)
-
Jun 2020 - Dec 2023: Research Scientist at Universitätsmedizin Göttingen, Germany.
-
Jun 2018 - May 2020: Research Scientist at Max Planck Institute for Dynamics and Self Organisation, Göttingen, Germany.
-
Apr 2017 - May 2018: Assistant professor at Leiden University Medical Center (LUMC), the Netherlands.
-
Apr 2014 - Mar 2017: Postdoctoral researcher at Leiden University Medical Center (LUMC), the Netherlands.
Éducation :
2007 - 2014: Integrated PhD in Physics (Masters + PhD programme), Indian Institute of Science, Bangalore, India2007 - 2009: Masters in Physics, Indian Institute of Science, Bangalore, India
2004 - 2007: BSc in Physics, Presidency College, Kolkata, India
Sélection de publications:
1. Dissolution of spiral wave’s core using cardiac optogenetics. S Hussaini, SL Lädke, J Schröder-Schetelig, V Venkatesan, RA Quiñonez Uribe, C Richter, R Majumder, S Luther. PLoS Comp Biol 19(12)e1011660 (2023). https://doi.org/10.1371/journal.pcbi.10116602. From Disorder to Normal Rhythm: Traveling-Wave Control of Cardiac Arrhythmias R Majumder, VS Zykov, E Bodenschatz. Physical Review Applied 17(6):064033. (2022) https://doi.org/10.1103/PhysRevApplied.17.064033
3. A mathematical model for electrical activity in pig atrial tissue Peris-Yagüe V, Rubio T, Fakuade FE, Voigt N, Luther S, Majumder R. Frontiers in Physiology:250 (2022) https://doi.org/10.3389/fphys.2022.812535
4. Drift and termination of spiral waves in optogenetically-modified cardiac tissue at sub-threshold illumination. S Hussaini, V Venkatesan, V Biasci, JM Romero Sepúlveda, RA Quiñonez Uribe, L Sacconi, G Bub, C Richter, V Krinski, U Parlitz, R Majumder, S Luther. eLife 10:e59954 (2021) https://doi.org/10.7554/eLife.59954
5. Pulsed low-energy stimulation initiates electric turbulence in cardiac tissue. R Majumder, S Hussaini, VS Zykov, S Luther, E Bodenschatz. PLoS Comp Biol 17(10): e1009476. (2021) https://doi.org/10.1371/journal.pcbi.1009476
6. Self-restoration of cardiac excitation rhythm by anti-arrhythmic ion channel gating. R Majumder, T De Coster, N Kudryashova, AO Verkerk, IV Kazbanov, B Ördög, N Harlaar, R Wilders, AAF de Vries, DL Ypey, AV Panfilov, DA Pijnappels. eLife 9:e55921 (2020) https://doi.org/10.7554/eLife.55921
7. Optogenetics enables real-time spatiotemporal control over spiral wave dynamics in an excitable cardiac system. R Majumder, I Feola, AS Teplenin, AAF de Vries, AV Panfilov, DA Pijnappels, eLife, 7:e41076, (2018) https://doi.org/10.7554/eLife.41076
8. Localized optogenetic targeting of rotors in atrial cardiomyocyte monolayers. I Feola, L Volkers, R Majumder, AS Teplenin, AAF de Vries, DA Pijnappels, Circulation: Arrhythmia and Electrophysiology, 10(11):e005591, (2017) https://doi.org/10.1161/CIRCEP.117.005591
9. Optogenetic manipulation of anatomical re-entry by light-guided generation of a reversible local conduction block. M Watanabe, I Feola, R Majumder, W Jangsangthong, AS Teplenin, DL Ypey, MJ Schalij, K Zeppenfeld, AAF de Vries, and DA Pijnappels, Cardiovascular Research, 113(3):354–366, (2017). https://doi.org/10.1093/cvr/cvx003
10. A Mathematical Model of Neonatal Rat Atrial Monolayers with Constitutively Active Acetylcholine-Mediated K+ Current. R Majumder, W Jangsangthong, I Feola, DL Ypey, DA Pijnappels, AV Panfilov, PLOS Computational Biology 12(6): e1004946. (2016). https://doi.org/10.1371/journal.pcbi.100494611. Islands of spatially discordant APD alternans underlie arrhythmogenesis by promoting electrotonic dyssynchrony in models of fibrotic rat ventricular myocardium. R Majumder, MC Engels, AAF de Vries, AV Panfilov, DA Pijnappels, Scientific Reports, 6, 24334 (2016). https://doi.org/10.1038/srep24334
12. Nonequilibrium Arrhythmic States and Transitions in a Mathematical Model for Diffuse Fibrosis in Human Cardiac Tissue. R Majumder, AR Nayak, R Pandit, PLOS ONE 7(10): e45040 (2012). https://doi.org/10.1371/journal.pone.0045040
Liens:
ResearchGate profile
ORCID profile
Google Scholar profile
Informations complémentaires
Offres d'emploi :
Je suis actuellement à la recherche d'étudiants en master et en doctorat très motivés, ainsi que de postdocs ayant une formation en ingénierie biomédicale, en bio-informatique ou en physique (avec un intérêt marqué pour la biologie). Si vous souhaitez rejoindre l'équipe et que vous aimez les défis qui vous font sortir des sentiers battus, j'aimerais beaucoup vous entendre !
